Важные аспекты двигательного восстановления пациента со спастическим парезом верхней конечности
Резюме
Двигательные нарушения в виде спастического пареза верхней конечности являются одним из наиболее частых последствий инсульта. При этом в конечности формируется моторный дефицит (слабость мышц/парез), отмечаются повышение мышечного тонуса, проприоцептивные нарушения и изменения в мышцах, суставах и окружающих тканях, что делает процесс ее функционального восстановления сложным, длительным и трудоемким.
В статье представлены факторы, оказывающие непосредственное влияние на восстановление функции верхней конечности после инсульта; показана важность своевременной диагностики всех развивающихся в ней изменений с применением необходимых оценочных шкал и создания оптимальных программ реабилитации с включением методик по восстановлению чувствительности, коррекции мышечного тонуса, современных методов реабилитации с биологической обратной связью (БОС) и т. д. Это помогает адаптировать пациентов в социуме и в быту, снизить уровень инвалидизации, что особенно важно для молодого и трудоспособного населения.
Анализ клинического наблюдения пациента Б. 22 лет с последствием инфаркта головного мозга в правой височно-теменной доле с хорошим функциональным исходом, благодаря использованию необходимых диагностических методов и индивидуально разработанной программе реабилитации, подчеркивает ценность и актуальность применения описанных в статье методик в процессе двигательного восстановления пациентов со спастическим парезом верхней конечности и проприоцептивными нарушениями после очагового поражения ЦНС.

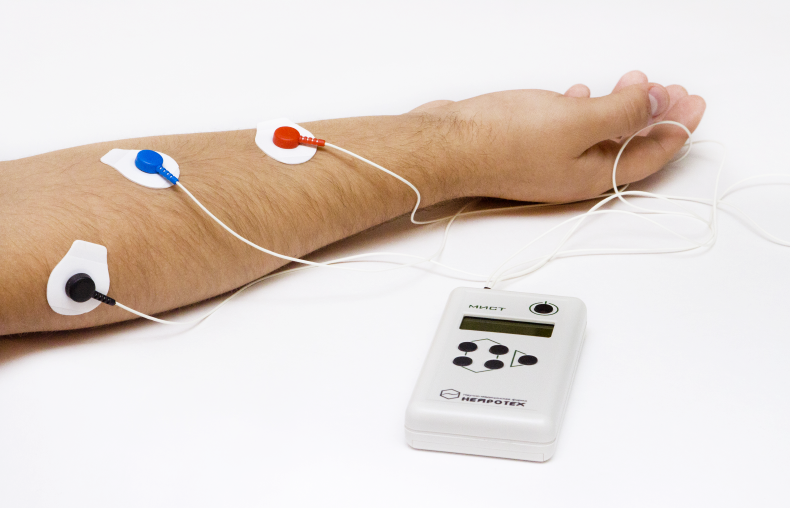
Комплексная система БОС «Колибри»
Беспроводная технология передачи данных позволяет считать датчики Колибри лучшим решением для проведения БОС-тренингов разных модальностей для детей.
ПодробнееВведение
В настоящее время инсульт остается второй ведущей причиной смертности и инвалидности во всем мире [1]. Наиболее частым последствием инсульта являются двигательные нарушения в виде спастического пареза верхней конечности различной степени выраженности [2]. Целый комплекс проблем, возникающих в верхней конечности после инсульта: моторный дефицит (слабость мышц/парез), повышение мышечного тонуса, проприоцептивные нарушения и неизбежно возникающие изменения в мышцах, суставах и окружающих тканях, делают процесс ее функционального восстановления сложным, длительным и трудоемким.
В связи с этим крайне актуальна своевременная диагностика всего комплекса изменений, развивающихся в верхней конечности, знание и использование необходимых оценочных шкал, а также создание оптимальных программ реабилитации с включением в них наиболее эффективных методов [3]. Восстановление функции верхней конечности является одной из ключевых задач реабилитации после инсульта, выполнение которой необходимо для социально-бытовой адаптации пациентов и снижения уровня инвалидизации, особенно у трудоспособной категории пациентов. В настоящей статье обсуждаются современные методы диагностики и реабилитации проприоцептивных нарушений и спастичности, поскольку их наличие у пациентов после инсульта приводит к неиспользованию конечности и напрямую влияет на ее двигательное восстановление [4].
Кроме того, демонстрируется эффективность имплементации в индивидуальные реабилитационные программы новых методик коррекции нарушений чувствительности, мышечного тонуса и методов реабилитации с биологической
обратной связью (БОС) на примере клинического наблюдения с хорошим функциональным исходом.
Факторы, влияющие на двигательное восстановление конечности после инсульта
Восстановление функции верхней конечности после инсульта является клинически значимой проблемой. Понимание факторов, которые влияют на этот процесс, необходимо для построения индивидуально адаптированных стратегий реабилитации [5]. Пациенты, перенесшие инсульт, демонстрируют различные модели восстановления движений в верхней конечности, поскольку инсульт является гетерогенным заболеванием [4].
В настоящее время показано, что по ряду клинических и нейровизуализационных факторов, таких как возраст, наличие движений в конечности сразу после инсульта, объем поражения головного мозга, сохранность кортикоспинального тракта, количество баллов по шкале инсульта Национального института здоровья (NIHSS) и выраженности межполушарной асимметрии, можно с большой степенью вероятности спрогнозировать восстановление конечности [5]. Негативными предикторами функционального восстановления конечности наряду с размерами и локализацией очага поражения (левополушарное поражение) являются выраженность пареза и спастичности, наличие нарушений проприоцептивной чувствительности (ПЧ), а также мужской пол и степень снижения повседневной активности (по шкале Бартела) [6]. Сохранность сенсорной системы (кожных механорецепторов, проприорецепторов суставов и мышц, а также органа зрения) очень важна для планирования (система прямой связи) и управления движением (система с обратной связью), а также для последующего моторного обучения. При наличии у пациента после инсульта проприоцептивных нарушений в верхней конечности изменяется существующая в норме связь с моторной функцией, что негативно влияет на управление двигательным актом и становится фактором, снижающим реабилитационный потенциал пациента [7].
В связи с этим актуально их своевременное выявление и включение в программу реабилитации методов для ее восстановления. Наряду с проприоцептивными нарушениями и выраженностью пареза в верхней конечности избыточное повышение мышечного тонуса (более 2 баллов по шкале Эшворта) уже в ранние сроки после инсульта также является предиктором ее плохого двигательного восстановления. Поэтому своевременные диагностика и начало антиспастического лечения могут помочь в достижении лучшего результата реабилитации, предотвратить развитие осложнений (контрактур, боли и др.) и повысить качество жизни пациентов после инсульта [8].
Проприоцептивные нарушения
Проприоцептивная чувствительность – ощущение взаимного положения и движения конечностей и тела. Она играет решающую роль в управлении движениями и двигательном обучении [9, 10]. Нарушение ПЧ наблюдается у многих пациентов, перенесших инсульт. У 50–80% пациентов двигательные нарушения в конечностях сочетаются с полной или частичной утратой способности ощущать движения в сегментах конечностей [9]. У пациентов с центральными парезами состояние ПЧ рассматривается как важный прогностический показатель возможности восстановления двигательных функций [5, 8–10].
Своевременная диагностика ПЧ и последующее составление индивидуального плана реабилитационных мероприятий, включающего методики по восстановлению чувствительности, позволяют значительно увеличить эффективность реабилитации. В клинической практике для оценки ПЧ чаще всего используют шкалы Фугл-Мейера (FMA) и Ноттингемскую. Шкала FMA является наиболее изученным и известным инструментом для оценки степени сенсомоторных нарушений после инсульта. Она содержит 5 доменов по оценке двигательной функции, чувствительности (тактильной и глубокой), равновесия, амплитуды движений в суставах, болевой чувствительности. В верхней конечности ПЧ оценивается по отдельным сегментам. Пациенту с закрытыми глазами врач производит пассивное движение в тестируемом суставе, после чего тот должен описать это движение вербально. Оценка осуществляется по 3-балльной шкале [11]. По Ноттингемской шкале оценивают нарушения тактильной чувствительности, стереогнозиса и кинестезии.
При оценке кинестезии по 4-балльной шкале в одном тесте оцениваются: распознавание самого факта движения, его направление и точность восприятия изменения суставного угла [12]. Тестирование каждого сегмента конечности повторяют по 3 раза. Процедура тестирования аналогична описанной выше (для FMA), но пациент воспроизводит ощущение движения вербально или движением другой конечности. Недостатками обоих методов являются низкая детализация описания нарушений и сложность тестирования пациентов с речевыми и когнитивными нарушениями. Кроме того, отставленное во времени воспроизведение движений, в некоторых случаях используемое при тестировании, задействует кинестетическую память, которая может быть нарушена у пациентов с поражением ЦНС. В последние годы для оценки ПЧ применяется новый метод, основанный на одновременном копировании серии циклических односуставных движений, позволяющий более точно судить о пространственно-временных характеристиках проприоцептивного восприятия [13, 14].
Метод позволяет определять у пациента наличие и степень нарушений ПЧ в отдельных сегментах конечностей и отслеживать динамику их изменений в ходе реабилитации [13]. Пациенту с закрытыми глазами врач проводит серию тестирующих пассивных циклических движений исследуемого сегмента конечности (3–4 цикла за 12–20 с) с варьирующимися амплитудой и скоростью. Пациент, согласно полученной инструкции, во время выполнения тестирующих движений должен копировать их противоположной конечностью. Перед началом тестирования необходимо убедиться, что пациент понимает задание и способен выполнить копирование противоположной, условно здоровой, конечностью. Для этого его просят выполнить процедуру копирования под зрительным контролем. Во время исследования с помощью беспроводных инерционно-магнитометрических датчиков регистрируются углы (рис. 1) в тестируемом суставе и одноименном суставе другой конечности.
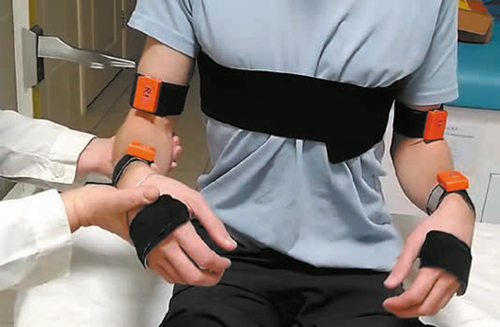
Рис. 1. Положение датчиков во время тестирования движений в локтевом суставе
На основе анализа зарегистрированных суставных углов оценивают схожесть пассивных и копирующих активных движений по качественным показателям, характеризующим наличие грубых нарушений при копировании, и по 4 количественным показателям:
- коэффициенту амплитуды (Камп);
- коэффициенту формы (Кфор);
- латентности начала копирования (Кнлат);
- средней в пределах теста латентности повторных циклических копирующих движений (Кцлат) [13].
Оценку степени сохранности проприоцептивного восприятия разных тест-движений проводят с использованием условного критерия нормы, разработанного при исследовании представительной выборки здоровых испытуемых. ПЧ признается сохранной, если копирование выполняется без качественных ошибок и значения не более 2 количественных показателей выходят за границы нормы [13, 14].
У здоровых испытуемых копирование происходит без качественных ошибок, с высокой точностью и практически без задержки. Таким способом можно объективно оценивать состояние ПЧ в любых сегментах конечности пациента в положении сидя или лежа, что дает возможность обследовать пациентов даже с самыми тяжелыми двигательными нарушениями. Метод позволяет проводить оценку состояния ПЧ даже без использования технических средств для регистрации суставных углов при копировании тест-движений. В этом случае оценка качества копирования может проводиться врачом визуально на основе только качественных показателей.
Для количественного выражения оценки состояния ПЧ может использоваться балльная шкала:
- 4 балла – пациент копирует все движения правильно и достаточно точно (ПЧ сохранна или близка к норме);
- 3 балла – копирует все движения правильно, но неточно, с видимой задержкой или искажением по амплитуде или форме движений (ПЧ ослаблена);
- 2 балла – правильно копирует только часть циклических тест-движений или выполняет дополнительные движения (среднее нарушение ПЧ);
- 1 балл – воспроизводит одиночное движение в том же суставе, но оно не совпадает ни с одним из пассивных тест-движений (сильное нарушение ПЧ);
- 0 баллов – копирующие движения вообще отсутствуют (полная потеря ПЧ) [9].
Спастичность
Умение выявлять спастичность уже в ранние сроки после инсульта важно для назначения адекватного лечения и составления соответствующей программы реабилитации с целью сохранения функции конечности. Для этого большинство специалистов используют 5-балльную модифицированную шкалу Эшворта (modified Ashworth Scale, mAS) [15]. В последние годы в клинической практике с этой целью также применяется модифицированная шкала Тардье (Modified Tardieu Scale – MTS), которая позволяет более точно определить и количественно измерить спастичность (угол, степень) [16]. Помимо выявления собственно спастичности, в реабилитационной практике с помощью ряда шкал оценивается степень ее влияния на активную и пассивную функцию конечности. Так, для оценки степени нарушения активной функции верхней конечности наиболее часто используют модифицированный тест Френчай (Modified Frenchay Test – MFT), шкалу оценки движений в руке (Action Research Arm Test – ARAT). Степень активности в повседневной жизни оценивают по шкале ограничения возможностей (Disability Assessment Scale – DAS), индексу Бартела (Barthel Index – BI) и др. [17, 18].
Ботулинотерапия спастичности
Уже несколько десятилетий препараты ботулинического токсина типа А (БТА) используются в реабилитации пациентов с поражениями ЦНС с фокальной и мультифокальной спастичностью для снижения мышечного тонуса и улучшения пассивной и активной функции верхней конечности [19]. Ботулинотерапия – эффективный и без опасный метод лечения спастичности с высоким уровнем убедительности рекомендаций [20–24]. Накоплен значительный клинический опыт использования препаратов БТА различных производителей, разработаны оптимальные терапевтические стратегии, отраженные в национальных и международных консенсусах разных стран и опубликованные в клинических рекомендациях национального и международного уровня [15, 19, 20]. В последнее десятилетие в России ботулинотерапия все более активно имплементируется в реабилитационный процесс в свете активно развивающейся доктрины 3-этапной системы реабилитации [15, 17, 18]. На российском рынке в начале 2000-х годов появились отечественные препараты БТА, один из которых – Релатокс® (АО «НПО «Микроген») с 2016 г. используется во многих реабилитационных центрах для лечения постинсультной спастичности верхней конечности после проведения многоцентрового простого слепого рандомизированного российского исследования «Оценка безопасности и эффективности препарата Релатокс® при спастичности руки после ишемического инсульта» [25]. За прошедшие с момента регистрации препарата 5 лет он доказал свою эффективность не только в снижении мышечного тонуса, увеличении объема активных и пассивных движений, но и в уменьшении уровня инвалидизации и боли, улучшении качества жизни пациентов [25].
БОС-технологии в реабилитации спастического пареза верхней конечности
Отсутствие поступления информации от конечности в соответствующие структуры головного мозга из-за пареза и проприоцептивных нарушений и ее неиспользование вследствие этого создает эффект «корковой деафферентации».
Для функционального восстановления конечности необходимо активирование путей «моторной адаптации». Это можно сделать с помощью метода БОС-тренировочного метода обучения сознательному контролю различных функций организма, прежде всего координации движений посредством принципа «обратной связи». С ее помощью можно частично заместить или усилить сенсорное восприятие производимых действий, моментально проанализировать и оценить результат. Посредством специальной аппаратуры пациенту через определенные стимулы (звуковые и визуальные образы) подается информация о функциональном состоянии мышц (или других органов) в реальном времени.
Пациент может изменять уровень активности конкретной группы мышц. Современные технологии позволяют формировать и другие каналы сенсорного восприятия (тактильные, вибропроприоцептивные и т. п.). Таким образом, у пациента формируются новые каналы связи между активностью его мышц и пониманием двигательного акта. Эти каналы в процессе тренировки частично, а иногда и полностью заменяют утраченную афферентацию. В настоящее время существует много различных современных устройств с БОС, используемых для восстановления верхней конечности (робототехника, экзоскелеты, виртуальная реальность и др.) [26].
Тренажеры с БОС вошли в стандарт оснащения центров и отделений медицинской реабилитации пациентов с соматическими заболеваниями, нарушениями функций опорно-двигательного аппарата, центральной и периферической нервной системы [27].
Одним из таких устройств, уже несколько лет успешно применяющихся в реабилитации пациентов со спастическими парезами верхней конечности, является отечественный комплекс коррекции движений «Колибри» – система, объединяющая в себе возможности корректора движений, электростимулятора и БОС-тренажера, с помощью которого можно стимулировать нужные мышцы, исправлять патологический двигательный стереотип и формировать новый, максимально приближенный к физиологическому [28].
Мультифункциональность комплекса, удобный и современный интерфейс, наличие беспроводных датчиков, «подстраивание» системы под индивидуальные возможности пациента и поэтапное усложнение программы, возможность дистанционного контроля выполнения сеансов и отслеживание эффективности медперсоналом, а также проведение тренинга в домашних условиях позволяют применять его не только на втором, но и на третьем этапе реабилитации, активно вовлекая пациента в процесс реабилитации, мотивируя его, что является крайне важным аспектом реабилитации.
Клиническое наблюдение
В качестве примера приводим результаты реабилитации пациента Б. 22 лет, находившегося в отделении медицинской реабилитации для взрослых с нарушениями центральной и периферической нервной системы ФГАУ «НМИЦ ЛРЦ» Минздрава России в марте-апреле и июне 2021 г. с диагнозом: цереброваскулярная болезнь, последствия инфаркта головного мозга от 09.06.2020 в правой височно-теменной доле с левосторонним спастическим гемипарезом, гемигипестезией, псевдобульбарной дизартрией, спастико-паретической формой.
При поступлении 22.03.2021 пациент отмечал снижение чувствительности в левой верхней конечности, невозможность ее использования в быту, ограничение сгибания кисти и пальцев, невозможность захвата предметов, участия руки в гигиенических и бытовых процедурах, а также подворот левой стопы во время ходьбы и сложности при произнесении слов. При физикальном осмотре значимых отклонений не было выявлено.
В неврологическом статусе: неравномерный спастический левосторонний гемипарез.
По шкале количественной оценки мышечной силы (Medical Research Council Weakness Scale – MRC)
- в руке: разгибание и сгибание в локтевом суставе – 3 балла, отведение и сгибание в плечевом суставе – 3 балла, сгибание и разгибание кисти – 2 балла, сгибание пальцев – 3 балла, разгибание – 1 балл;
- в ноге: разгибание и сгибание в тазобедренном суставе – 4 балла, разгибание в коленном суставе – 4 балла, сгибание – 3 балла, подошвенное сгибание стопы – 4 балла, тыльное сгибание стопы – 3 балла.
Мышечный тонус повышен по спастическому типу в мышцах: круглом пронаторе, сгибателях кисти и пальцев, в сгибателях локтевого сустава – 3 балла, сгибателях плечевого сустава – 1 балл, разгибателях коленного сустава и подошвенных сгибателях стопы – 3 балла.
Повышение сухожильных и периостальных рефлексов в левых конечностях и патологические стопные знаки (симптом Бабинского). Левосторонняя поверхностная и глубокая гемигипестезия в левых конечностях, более выраженная в руке. Координаторные пробы слева выполняет с мимопопаданием и неточностью. В пробе Ромберга неустойчив. Функции тазовых органов контролирует. Ходит с опорой на трость, используя зрительный контроль. Псевдобульбарная дизартрия, спастико-паретическая форма. Когнитивная и психическая сфера – норма: тест MoCA – 28 баллов, госпитальная шкала HADS – Т7, Д5. Общий балл по шкале FMA – 181 (норма – 226). Двигательная функция – 63 балла (верхняя конечность – 34 + нижняя конечность – 29) (норма – 66 + 34 балла соответственно). Равновесие – 11 баллов (норма – 14). Чувствительность – 19 баллов (норма – 24): поверхностная – 5 баллов (норма – 8), глубокая – 14 баллов (норма – 14). Объем движений и болевая чувствительность в суставах в норме – 44 + 44 балла. Ноттингемская шкала – 16 баллов: плечевой сустав, локтевой сустав, пронация/супинация предплечья – по 3 балла, лучезапястный сустав, пальцы кисти – 2 балла; тазобедренный, коленный, голеностопный суставы – 3 балла, палец стопы – 2 балла. Индекс Бартела – 90 баллов. Оценка по шкале реабилитационной маршрутизации (ШРМ) – 3 балла. При составлении реабилитационной программы у пациента со спастическим парезом верхней конечностии проприоцептивными нарушениями мультидисциплинарной реабилитационной командой (МДРК) в составе врача по физической и реабилитационной медицине, врача ЛФК, врача-физиотерапевта, логопеда и нейропсихолога были выбраны следующие домены по МКФ [26]: b260.3 проприоцептивная функция (тяжелые нарушения), b7301.3 сила мышц одной конечности (тяжелые нарушения), b7351.2 тонус мышц одной конечности (умеренные нарушения), b398.2 функции голоса и речи (умеренные нарушения), b144.0 функции памяти (норма), b160.0 функции мышления (норма). Определена цель лечения: обучение использованию руки в бытовых действиях (гигиена, одевание, употребление пищи и др.).
Поставлены задачи:
- уменьшение проприоцептивных нарушений и вовлечение руки в бытовые действия;
- снижение тонуса на 1 балл в мышцах: круглом пронаторе, сгибателях кисти и пальцев, в сгибателях локтевого сустава и увеличение объема движений в локтевом, лучезапястном суставах и пальцах кисти в левой руке с целью улучшения движений: пронации/супинации, сгибания/разгибания в локтевом суставе, кисти, пальцах;
- увеличение скорости ходьбы;
- улучшение произнесения слов, фазовой речи.
С целью восстановления ПЧ проведена ее инструментальная оценка с помощью регистрации суставных углов пассивных и копирующих активных движений в 8 тестах для руки: плечевой сустав – сгибание/разгибание (ПСР), отведение/приведение (ПОП), локтевой сустав – сгибание/разгибание (ЛСР), пронация/супинация предплечья (ПС), кисть – сгибание/разгибание (КСР), отведение/приведение (КОП). Все тесты проводили под зрительным контролем и с закрытыми глазами. Предварительное тестирование показало, что имеются грубые нарушения ПЧ в дистальных сегментах паретичной верхней конечности (рис. 2).
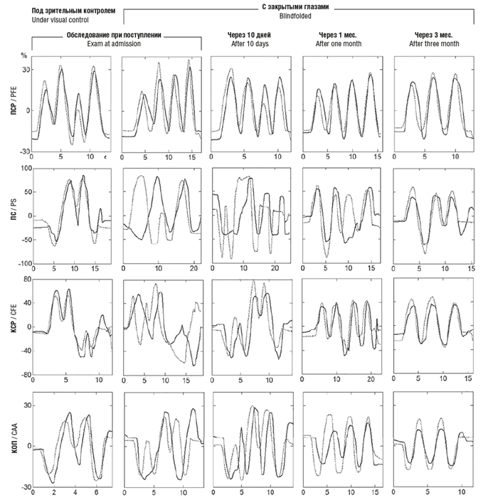 Рис. 2. Точность копирования тест-движений различных сегментов паретичной руки на разных стадиях реабилитации. Пунктирные линии – изменение суставных углов во времени при регистрации пассивных движений, сплошные линии – активных движений; ПСР – сгибание/разгибание в плечевом суставе; ПС – пронация/супинация предплечья; КСР – сгибание/разгибание, КОП – отведение/приведение в лучезапястном суставе. Пояснения в тексте
Рис. 2. Точность копирования тест-движений различных сегментов паретичной руки на разных стадиях реабилитации. Пунктирные линии – изменение суставных углов во времени при регистрации пассивных движений, сплошные линии – активных движений; ПСР – сгибание/разгибание в плечевом суставе; ПС – пронация/супинация предплечья; КСР – сгибание/разгибание, КОП – отведение/приведение в лучезапястном суставе. Пояснения в тексте
С учетом полученных данных для пациента был разработан индивидуальный план реабилитационных мероприятий. В качестве тренировочных упражнений, направленных на восстановление ПЧ движений предплечья и кисти, выполнялись упражнения по одновременному копированию с закрытыми глазами пассивных движений паретичной конечностью.
Эффективность их применения оценивали на основе мониторинга сенсомоторных показателей отдельных сегментов руки, в том числе ПЧ. Реабилитационная программа также включала:
- занятия по восстановлению моторной функции руки на роботизированном оборудовании с БОС «Армео», «Амадео» и комплексе «Колибри» (3 × 30 мин) по № 10;
- занятия по восстановлению мелкой моторики (30 мин) № 20;
- ЛФК индивидуально (2 р/сут по 30 мин) № 20;
- занятия на комплексе для анализа и коррекции нарушений ходьбы и координации движений с помощью расширенной виртуальной реальности С-Mill VR+ (30 мин) № 20;
- занятия с логопедом.
Пациент прошел 2 курса реабилитации в стационаре (22.03–12.04.2021 и 19.04–03.05.2021), между которыми проводилась амбулаторная реабилитация с идентичной программой.
В начале второго курса реабилитации в круглосуточном стационаре (19.04.2021) в связи со спастичностью в мышцах верхней конечности, затрудняющей процесс двигательного восстановления, под ультразвуковым контролем проведена инъекция БТА (Релатокс® в дозе 200 Ед: в лучевой и локтевой сгибатели кисти по 30 ЕД (суммарно60 ЕД), мышцы поверхностный и глубокий сгибатели пальцев по 50 ЕД, мышцу круглый пронатор 40 ЕД. Повторные тестирования ПЧ всех сегментов руки, проведенные через 10 дней, 1 мес. и 3 мес. от начала тренировки, показали улучшение копирования по количественным пространственно-временным показателям, но с отличающейся динамикой в различных сегментах конечности (рис. 3).
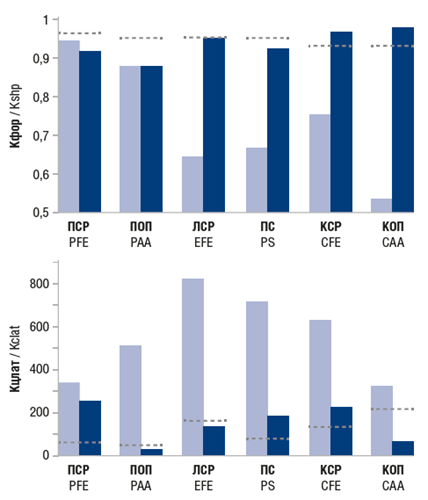 Рис. 3. Точность копирования с закрытыми глазами формы пассивных тест-движений паретичной руки (Кфор) и задержки между повторяющимися пассивными и копирующими активными движениями (Кцлат) до (светлые столбики) и через 3 мес. после (темные столбики) реабилитационных мероприятий у пациента Б
Рис. 3. Точность копирования с закрытыми глазами формы пассивных тест-движений паретичной руки (Кфор) и задержки между повторяющимися пассивными и копирующими активными движениями (Кцлат) до (светлые столбики) и через 3 мес. после (темные столбики) реабилитационных мероприятий у пациента Б
Метод диагностики ПЧ в сочетании с тренировками подтверждает важную роль обучения в восстановлении проприоцепции у пациентов с парезами в верхней конечности центрального генеза [9].
Через 3 мес. (после 2 курсов реабилитации в круглосуточном стационаре и активных (по 4–5 ч в день) амбулаторных занятий самореабилитацией с упражнениями по восстановлению ПЧ и использованием БОС-тренажера комплекса «Колибри) была отмечена значимая положительная динамика и достигнуты цели: расширились функциональные возможности верхней конечности, пациент стал использовать руку в быту (открывать/закрывать дверь, держать телефон, книгу, нажимать кнопки в лифте, использовать ее во время приема пищи, проведения гигиенических процедур и др.) и задачи реабилитации:
- уменьшилась выраженность чувствительных нарушений: отмечено восстановление поверхностной и глубокой чувствительности в мышцах предплечья и кисти (Ноттингемская шкала – 22 балла, по шкале FMA отмечено расширение функциональных возможностей руки с 34 до 37 баллов (общий балл – 190));
- снизился мышечный тонус на 1 балл через 1 мес. в мышцах-сгибателях кисти и пальцев (с 3 до 2 баллов). Нормализовался мышечный тонус в мышцах-сгибателях плечевого сустава. На фоне снижения мышечного тонуса произошло увеличение объема движений во всех суставах конечности. Наросла сила в мышцах-сгибателях и мышцах-разгибателях кисти и пальцев на 2 балла; в мышцах-сгибателях плечевого, локтевого, лучезапястного суставах, в мышцах-разгибателях плечевого сустава на 1 балл. Кроме того, значимо увеличилась скорость ходьбы и улучшилась речь. Все эти изменения позитивно сказались на уровне независимости пациента: ШРМ – 2 при выписке, индекс Бартела – 95 баллов.
Таким образом, положительный эффект проведенной реабилитации у пациента со спастическим парезом верхней конечности с грубым моторным и проприоцептивным дефицитом и целым спектром сопутствующих неврологических проблем – даже спустя 9 мес. после инсульта – был достигнут благодаря правильной оценке МДРК всех составляющих неврологического дефицита с применением МКФ, использованию как давно известных диагностических шкал, так и новых, апробируемых инструментов оценки; адекватно составленной реабилитационной программе с применением как традиционно используемых, так и инновационных методов, включая ботулинотерапию; проведению интенсивной и непрерывной самореабилитации с использованием упражнений по восстановлению ПЧ и БОС-технологий. Возможно, что появляющиеся в последние годы отечественные разработки: методы диагностики и реабилитации (оценка ПЧ и упражнения по ее восстановлению), реабилитационное оборудование (комплекс с БОС «Колибри») и медикаменты (препарат Релатокс®) внесут значимый вклад в реализацию программы 3-этапной реабилитации на территории нашей страны. Безусловно, эффективность их применения еще требует подтверждения и проведения исследований, однако не менее важен анализ отдельных клинических ситуаций, что и представлено в настоящей публикации.
Литература
- Katan M., Luft A. Global Burden of Stroke. Semin Neurol. 2018;38(2):208–211. DOI: 10.1055/s-0038-1649503.
- Gracies J.M., Bayle N., Vinti M. et al. Five-step clinical assessment in spastic paresis. Eur J Phys Rehabil Med. 2010;46(3):411–421. PMID: 20927007.
- Stinear C.M., Lang C.E., Zeiler S., Byblow W.D. Advances and challenges in stroke rehabilitation. Lancet Neurol. 2020;19(4):348–360. DOI: 10.1016/S1474-4422(19)30415-6.
- Langhorne P., Bernhardt J., Kwakkel G. Stroke rehabili-tation. Lancet. 2011;377:1693–1702. DOI: 10.1016/S0140-6736(11)60325-5.
- Lee J., Kim H., Kim J. et al. Differential early predictive factors for upper and lower extremity motor recovery after ischaemic stroke. Eur J Neurol. 2021;28(1):132–140. DOI: 10.1111/ene.14494.
- Левин О.С. Постинсультные двигательные нарушения. Современная терапия в психиатрии и неврологии. 2016;(3):25–32.
- Schabrun S.M., Hillier S. Evidence for the retraining of sensation after stroke: a systematic review. Clin Rehabil. 2009;(23):27–39. DOI: 10.1177/0269215508098897.
- Glaess-Leistner S., Song J.R., Audebert H.J., Wissel J. Early clinical predictors of post stroke spasticity. Top Stroke Rehabil. 2021;28(7):508–518. DOI: 10.1080/10749357.2020.1843845.
- Ostry D.J., Gribble P.L. Sensory plasticity in human motor learning. Trends Neurosci. 2016;39(2):114–123. DOI: 10.1016/j.tins.2015.12.006.
- Coupar F., Pollock A., Rowe P. et al. Predictors of upper limb recovery after stroke: a systematic review and meta-analysis. Clin Rehabil. 2009;(260):291–313. DOI: 10.1177/0269215511420305.
- Fugl-Meyer A.R., Jääskö L., Leyman I. et al. The post-stroke hemiplegic patient. 1. a method for evaluation of physical performance. Scand J Rehabil Med. 1975;7(1):13–31.
- Semrau J.A., Herter T.M., Scott S.H., Dukelow S.P. Robotic identification of kinesthetic deficits after stroke. Stroke. 2013:(44):3414–3421. DOI: 0.1161/STROKEAHA.113.002058.
- Павлова О.Г., Рощин В.Ю., Сидорова М.В. и др. Метод качественной и количественной оценки восприятия движений в отдельных суставах руки. Физиология человека. 2018;44(4):84–95. DOI: 10.1134/S0131164618040124.
- Рощин В.Ю., Павлова О.Г., Селионов В.А. и др. Сравнение объективных показателей проприоцептивного восприятия односуставных движений руки в положениях сидя и лежа у здоровых испытуемых и постинсультных больных. Физиология человека. 2019;45(4):62–70. DOI: 10.1134/S0131164619040131.
- Gracies J.M. Coefficients of impairment in deforming spastic paresis. Ann Phys Rehabil Med. 2015;58(3):173–178. DOI: 10.1016/j.rehab.2015.04.004.
- Хатькова С.Е. Современные тенденции в лечении постинсультной спастичности с использованием ботулинотерапии. Журнал неврологии и психиатрии им. С.С. Корсакова. 2012;112(8):92–99.
- Хатькова С.Е., Орлова О.Р., Боцина А.Ю. и др. Основные принципы ведения пациентов с нарушением мышечного тонуса после очагового повреждения головного мозга. Consilium Medicum. 2016;18(2–1):25–33.
- Varvarousis D.N., Dimopoulos D., Vasileiadis G.I. et al. Do gait parameters improve after botulinum toxin injections in post stroke patients? A prospective
study. Toxicon. 2021;200:189–197. DOI: 10.1016/j.toxicon.2021.08.001. - Hoare B.J., Wallen M.A., Imms C. et al. Botulinum toxin A as an adjunct to treatment in the management of the upper limb in children with spastic cerebral palsy (UPDATE). Cochrane Database Syst Rev. 2010;2010(1):CD003469. DOI: 0.1002/14651858.CD003469.pub4.
- McIntyre A., Lee T., Janzen S. et al. Systematic review of the effectiveness of pharmacological interventions in the treatment of spasticity of the hemiparetic lower extremity more than six months post stroke. Top Stroke Rehabil. 2012;19(6):479–490. DOI: 10.1310/tsr1906-479.
- Ng Y., Chew E., Samuel G. et al. Advances in rehabilitation medicine, Singapore Med. J. 2013;54:538–551.
- Schramm A., Ndayisaba J.P., Auf dem Brinke M. et al. Spasticity treatment with onabotulinumtoxin A: data from a prospective Germanreal -life patient registry. J Neural Transm (Vienna). 2014;121(5):521–530. DOI: 10.1007/s00702-013-1145-3.
- Simpson D.M., Hallett M., Ashman E.J. et al. Practice guideline update summary: Botulinum neurotoxin for the treatment of blepharospasm, cervical dystonia, adult spasticity, and headache: Report of the Guideline Development Subcommittee of the American Academy of Neurology. Neurology. 2016;86(19):1818–1826. DOI: 10.1212/WNL.0000000000002560.
- Wu J., Cheng H., Zhang J. et al. Robot-Assisted Therapy for Upper Extremity Motor Impairment After Stroke: A Systematic Review and MetaAnalysis. Phys Ther. 2021;101(4):pzab010. DOI: 10.1093/ptj/pzab010.
- Хатькова С.Е., Костенко Е.В., Похабов Д.В. и др. Оценка безопасности и эффективности российского препарата ботулотоксина А Релатокс® в сравнении с Ботоксом® при спастичности руки после ишемического инсульта (мультицентровое рандомизированное исследование). Неврология, нейропсихиатрия, психосоматика. 2017;9(1):71–77.26.
- International Classification of Functioning, Disability and Health (ICF) (Electronic resource.) URL (access date: 08.17.2021).
- Приказ МЗ РФ №1705н от 29 декабря 2012 г. (Электронный ресурс.) URL (дата обращения: 29.12.2012).
- Система БОС «Колибри» комплексная — Нейротех. (Электронный ресурс.) URL (дата обращения: 17.08.2021).
Сведения об авторах
- Хатькова Светлана Евгеньевна – д.м.н., профессор, заведующая отделением медицинской реабилитации взрослых с нарушениями функции центральной и периферической нервной системы ФГАУ «НМИЦ ЛРЦ» Минздрава России; 125367, Россия, г. Москва, Иваньковское шоссе, д. 3; ORСID iD 0000-0002-3071-4712.
- Николаев Евгений Андреевич – врач-невролог ФГАУ «НМИЦ ЛРЦ» Минздрава России; 125367, Россия, г. Москва, Иваньковское шоссе, д. 3; ORСID iD 0000-0000-0003-0443-3201.
- Погорельцева Оксана Александровна – к.м.н., заведующая неврологическим отделением ФГАУ «НМИЦ ЛРЦ» Минздрава России; 125367, Россия, г. Москва, Иваньковское шоссе, д. 3; ORСID iD 0000-0003-1141-0091.
- Павлова Ольга Геннадьевна – д.биол.н., ведущий научный сотрудник ИВНД и НФ РАН; 117485, Россия, г. Москва, ул. Бутлерова, д. 5а; ORСID iD 0000-0001-5238-8383.
- Рощин Вадим Юрьевич – ведущий инженер ИВНД и НФ РАН; 117485, Россия, г. Москва, ул. Бутлерова, д. 5а; ORСID iD 0000-0003-4994-2376.
- Котляров Валерий Викторович – к.м.н., врач-невролог, врач функциональной диагностики, ООО «Поликлиника»; 357500, Россия, г. Пятигорск, ул. Широкая, д. 9.